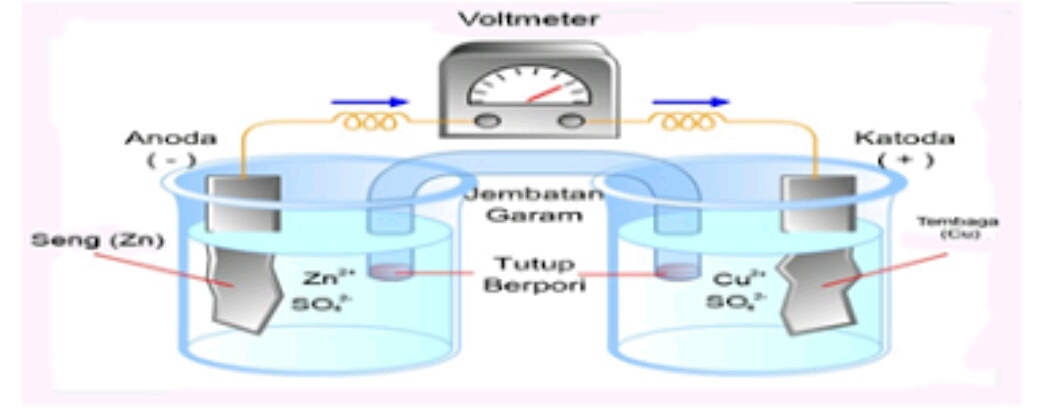
(Ket, Poto Gambar Sel volta yang menggunakan jembatan garam)
Oleh: Dr. Imelda
Departemen Kimia FMIPA Universitas Andalas
PADANG – ENERGI yang dibebaskan dalam reaksi redoks spontan dapat digunakan untuk melakukan kerja listrik. Tugas ini dicapai dengan menggunakan sel volta atau galvani, suatu alat dimana perpindahan elektron terjadi melalui lintasan luar.
Misalnya bila dua buah elektroda yang berbeda jenisnya (misal elektroda Zn dan elektroda Cu) dihubungkan dengan kawat yang dilengkapi voltmeter, juga dihubungkan dengan jembatan garam, maka logam Zn akan teroksidasi menjadi Zn2+ Elektron yang dihasilkan oleh Zn mengalir melalui voltmeter menuju ke arah elektroda Cu.
Selanjutnya elektron tersebut ditangkap oleh ion Cu2+ dalam larutan Cu(NO3)2. Cu yang dihasilkan mengendap pada batang logam Cu, sehingga batang logam Cu makin tebal (massanya bertambah).
Logam Zn megalami oksdasi, maka elektroda ini disebut anoda, dan menjadi kutub negatif (karena menghasilan elektron). Ion Cu2+ mengalami reduksi menjadi Cu dan menempel pada katoda sebagai kutub positif.
Selain menggunakan Zn/Zn2+ dan Cu/Cu2+ dapat juga digunakan elektroda inert (C, Pt dan Au) dengan elektrolit pasangan redoks seperti KMnO4 atau I2 dengan asam organik seperti alcohol, asam sitrun, asam cuka dan lain-lain.
Praktikum sel volta dapat dengan mudah dilakukan hanya dengan menggunakan bahan-bahan sederhana dan tersedia disekitar kita seperti prosedur dibawah dibawah ini:
Alat dan bahan: Multimeter Kawat tembaga dan seng (ukuran 2 x 5 cm) Pensil 2B (2 buah). Kabel Listrik dengan penjepit buaya. Lampu senter/LED/multimeter KMnO4 (bubuk Peka, tersedia di apotik sebagai obat kulit)
Asam citrun (sebagai pemberi rasa asam pada es buah). Bubuk CuSO4 ( Terusi digunakan untuk menjernihkan kolam). Bubuk ZnSO4 (tersedia sebagai pupuk).
Cara kerja Sel dengan elektroda tembaga (Cu) dan seng(Zn) Kabel listrik dihubungkan ke alat multimeter / lampu LED(senter), atur potensial peralatan. Kabel listrik dihubungkan dengan elektroda, terdiri dari elektroda katoda (kawat tembaga) dan anoda (seng). Elektroda Zn kemudian dicelupkan ke larutan ZnSO4 dan elektroda Cu kemudian dicelupkan ke elektrolit CuSO4.
Kedua elektrolit kemudian dihubungkan dengan jembatan garam, dimana jembatan garam dibuat dengan mencelupkan kertas tisu ke larutan NaCl. Hitung arus yang terbaca pada alat multimeter
Ujung elektroda kemudian dihubungkan dengan elektrolit (jeruk nipis, kentang, tomat, larutan NaCl, tomat dll).
Amati nilai arus yang terbaca pada alat ampermeter atau amati kekuatan sinar dari lampu. Sel dengan elektroda carbon (pensil 2B). Kabel listrik dihubungkan ke alat multimeter //lampu LED (senter), atur potensial peralatan.
Kabel listrik dihubungkan dengan elektroda, kedua elektrodanya adalah karbon (pensil 2B)
Elektroda katoda kemudian dicelupkan ke dalam larutan KMnO4 dan elektroda anoda kemudian dicelupkan ke larutan asam citrun.
Kedua elektrolit kemudian dihubungkan dengan jembatan garam, dimana jembatan garam dibuat dengan mencelupkan kertas tisu ke larutan NaCl. Hitung arus yang terbaca pada alat multimeter.
Pengamatan juga bisa dilakukan dengan menggunakan elektrolit NaCl (garam dapur), kentang, jeruk nipis, tomat, asam cuka dan lain-lain dengan menggunakan elektroda tembaga, seng, besi maupun karbon.
Nah, mudah bukan?…selamat mencoba.